Bravecto 150 mg/ml Pulver und Lösungsmittel zur Herstellung einer Injektionssuspension für Hunde

Antiparasitikum (Fluralaner)
Zusammensetzung
| Durchstechflasche mit Pulver: | Durchstechflasche mit Lösungsmittel: | Rekonstituierte Suspension: |
|---|---|---|
| Jede Durchstechflasche enthält: Wirkstoff: Fluralaner 2,51 g | Jeder ml enthält: Sonstige Bestandteile: Benzylalkohol 22,3 mg | Jeder ml enthält: Wirkstoff: Fluralaner 150 mg Sonstige Bestandteile: Benzylalkohol 20 mg |
| Weißes bis blassgelbes Pulver. | Klare bis undurchsichtige viskose Lösung. | Undurchsichtige weiße bis blassgelbe, leicht viskose Suspension. |
Zieltierart(en)
Hund
Anwendungsgebiet(e)
Zur Behandlung von Zecken- und Flohbefall bei Hunden.
Dieses Tierarzneimittel ist ein systemisches Insektizid und Akarizid und bietet eine
- sofortige und anhaltende abtötende Wirkung gegen Flöhe (Ctenocephalides felis und Ctenocephalides canis) über 12 Monate,
- anhaltende Zecken-abtötende Wirkung ab Tag 3 bis 12 Monate nach der Behandlung gegen Ixodes ricinus, Ixodes hexagonus und Dermacentor reticulatus,
- anhaltende Zecken-abtötende Wirkung ab Tag 4 bis 12 Monate nach der Behandlung gegen Rhipicephalus sanguineus.
Flöhe und Zecken müssen am Wirt anheften und mit der Nahrungsaufnahme beginnen, um dem Wirkstoff ausgesetzt zu werden.
Das Tierarzneimittel kann als Teil der Behandlungsstrategie gegen die allergische Flohdermatitis (FAD) eingesetzt werden.
Zur Verringerung des Infektionsrisikos mit Babesia canis canis mittels Übertragung durch Dermacentor reticulatus ab Tag 3 nach der Behandlung für bis zu 12 Monate. Die Wirkung erfolgt indirekt durch die Aktivität des Tierarzneimittels gegen den Vektor.
Zur Verringerung des Infektionsrisikos mit Dipylidium caninum durch die Übertragung durch Ctenocephalides felis für bis zu 12 Monate. Die Wirkung erfolgt indirekt durch die Wirksamkeit des Tierarzneimittels gegen den Vektor.
Gegenanzeigen
Nicht anwenden bei Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile.
Besondere Warnhinweise
Besondere Warnhinweise:
Parasiten müssen mit der Nahrungsaufnahme auf dem Wirt beginnen, um gegen Fluralaner exponiert zu werden. Deshalb kann ein Risiko der Übertragung von Krankheiten durch Parasiten (einschließlich Babesia canis canis und D. caninum) nicht vollständig ausgeschlossen werden.
Eine unnötige oder von den Vorgaben in der Fachinformation abweichende Anwendung von Antiparasitika kann den Resistenzselektionsdruck erhöhen und zu einer verminderten Wirksamkeit führen. Die Entscheidung über die Anwendung des Tierarzneimittels sollte auf dem Nachweis der Parasitenspezies und der Befallsstärke bzw. des Infektionsrisikos, welches auf den epidemiologischen Besonderheiten (unter Berücksichtigung der Wirkdauer des Tierarzneimittels von 12 Monaten) jedes Einzeltieres basiert, beruhen.
Die Möglichkeit, dass andere im gleichen Haushalt lebende Tiere eine Quelle für eine Reinfektion mit Parasiten sein können, sollte berücksichtigt werden. Diese Tiere sollten gegebenenfalls mit einem geeigneten Tierarzneimittel behandelt werden.
Besondere Vorsichtsmaßnahmen für die sichere Anwendung bei den Zieltierarten:
Die Verträglichkeit des Tierarzneimittels bei Hunden mit vorbestehender Epilepsie wurde nicht untersucht. Daher bei solchen Hunden mit Vorsicht und basierend auf einer Nutzen-Risiko-Bewertung durch den verantwortlichen Tierarzt anwenden.
Das Tierarzneimittel sollte nicht bei Hunden im Alter von weniger als 6 Monaten angewendet werden, da hierzu keine Daten vorliegen.
Besondere Vorsichtsmaßnahmen für den Anwender:
Es wurde über Überempfindlichkeitsreaktionen auf Fluralaner oder Benzylalkohol beim Menschen berichtet, die möglicherweise schwerwiegend sein können. Ebenso können Reaktionen an der Injektionsstelle auftreten. Bei der Verabreichung dieses Tierarzneimittels sollte darauf geachtet werden, dass eine versehentliche Selbstinjektion und Hautexposition vermieden werden. Bei versehentlicher Selbstinjektion mit Nebenwirkungen, Überempfindlichkeitsreaktionen oder Reaktionen an der Injektionsstelle, wenden Sie sich an einen Arzt und zeigen Sie das Etikett oder die Packungsbeilage vor. Nach Anwendung die Hände waschen.
Dieses Tierarzneimittel darf nur von Tierärzten oder unter deren strenger Aufsicht verabreicht werden.
Trächtigkeit und Laktation:
Die Unbedenklichkeit des Tierarzneimittels während der Trächtigkeit und Laktation ist nicht belegt.
Nur anwenden nach entsprechender Nutzen-Risiko-Bewertung durch den behandelnden Tierarzt.
Wechselwirkung mit anderen Arzneimitteln und sonstige Wechselwirkungen:
Fluralaner wird in hohem Maße an Plasmaproteine gebunden und kann mit anderen stark bindenden Wirkstoffen, wie nicht-steroidalen Entzündungshemmern (NSAIDs) oder dem Cumarin-Derivat Warfarin, konkurrieren. Die Inkubation von Fluralaner in Hundeplasma in Gegenwart von Carprofen oder Warfarin in den maximal anzunehmenden Plasmakonzentrationen reduzierte die Proteinbindung von Fluralaner, Carprofen oder Warfarin nicht.
Während der klinischen Feldstudien wurden keine Wechselwirkungen zwischen diesem Tierarzneimittel und routinemäßig verabreichten Tierarzneimitteln einschließlich Impfstoffen beobachtet.
Überdosierung:
Nach der subkutanen Verabreichung des 3- und 5-fachen der empfohlenen Dosis von 15 mg Fluralaner/kg Körpergewicht alle 4 Monate für insgesamt 6 Dosen (Tage 1, 120, 239, 358, 477 und 596) an 6 Monate alte Welpen beschränkte sich der einzige behandlungsbedingte Befund auf Schwellungen an der Injektionsstelle, die sich im Laufe der Zeit zurückbildeten.
Der Wirkstoff Fluralaner wurde bei Collies mit einem fehlenden Multiresistenz-Protein 1 (MDR1 -/-) nach einmaliger oraler Verabreichung mit dem 3-fachen der empfohlenen Höchstdosis (168 mg/kg Körpergewicht) gut vertragen. Da die maximale systemische Exposition gegenüber Fluralaner nach subkutaner Verabreichung im Vergleich zur oralen Verabreichung nicht höher ist, ist die subkutane Injektion des Tierarzneimittels bei MDR1(-/-) Hunden als sicher anzusehen.
Wesentliche Inkompatibilitäten:
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Tierarzneimittel nicht mit anderen Tierarzneimitteln gemischt werden.
Nebenwirkungen
Hund:
| Häufig (1 bis 10 Tiere / 100 behandelte Tiere): |
| Schwellung an der Injektionsstelle1 |
| Gelegentlich (1 bis 10 Tiere / 1 000 behandelte Tiere): |
| Verminderter Appetit, Müdigkeit, Hyperämische Schleimhäute |
| Sehr selten (< 1 Tier / 10 000 behandelte Tiere, einschließlich Einzelfallberichte): |
| Muskelzittern, Ataxie (Koordinationsstörungen), Krämpfe |
1Tastbare und/oder sichtbare Schwellungen, nicht entzündlich, nicht schmerzhaft, mit der Zeit von selbst abklingend
Die Meldung von Nebenwirkungen ist wichtig. Sie ermöglicht die kontinuierliche Überwachung der Verträglichkeit eines Tierarzneimittels. Falls Sie Nebenwirkungen, insbesondere solche, die nicht in der Packungsbeilage aufgeführt sind, bei Ihrem Tier feststellen, oder falls Sie vermuten, dass das Tierarzneimittel nicht gewirkt hat, teilen Sie dies bitte zuerst Ihrem Tierarzt mit. Sie können Nebenwirkungen auch an den Zulassungsinhaber unter Verwendung der Kontaktdaten am Ende dieser Packungsbeilage oder über Ihr nationales Meldesystem.
Dosierung für jede Tierart, Art und Dauer der Anwendung
Zur subkutanen Anwendung.
Verabreichung von 0,1 ml rekonstituierter Suspension pro kg Körpergewicht (entspricht 15 mg Fluralaner pro kg Körpergewicht) subkutan, z.B. zwischen den Schulterblättern (dorso-scapulare Region) des Hundes. Der Hund sollte zum Zeitpunkt der Dosierung gewogen werden, um eine genaue Dosis zu berechnen.
Eine Unterdosierung kann zu einer unwirksamen Anwendung führen und eine Resistenzentwicklung begünstigen.
Die folgende Tabelle kann als Dosierungsleitfaden verwendet werden:
| Körpergewicht des Hundes (kg) | Volumen der rekonstituierten Suspension (ml) |
|---|---|
| 5 | 0,5 |
| 10 | 1 |
| 15 | 1,5 |
| 20 | 2 |
| 25 | 2,5 |
| 30 | 3 |
| 35 | 3,5 |
| 40 | 4 |
| 45 | 4,5 |
| 50 | 5 |
| 55 | 5,5 |
| 60 | 6 |
Für Hunde, die weniger als 5 kg oder mehr als 60 kg wiegen, ist die Dosis entsprechend zu berechnen.
Hinweise für die richtige Anwendung
Rekonstitution der Suspension vor dem ersten Gebrauch:
1 Durchstechflasche Pulver mit 15 ml Lösungsmittel anmischen. Es wird empfohlen, eine sterile 18 G-Transfernadel und eine sterile 20-ml-Spritze für die Anmischung des Produkts zu verwenden.
- Schütteln Sie die Durchstechflasche mit Fluralaner-Pulver, um mögliche Aggregate vor der Anmischung aufzubrechen.
- Drehen Sie die Durchstechflasche mit dem Lösungsmittel mindestens drei Mal, bis der Inhalt sichtbar gleichmäßig ist.
- Injizieren Sie zuerst bis zu 14 ml Luft in die Durchstechflasche mit Lösungsmittel und entnehmen Sie dann 15 ml des Lösungsmittels aus der Durchstechflasche (Abbildung A). In der Durchstechflasche befindet sich mehr Lösungsmittel, als für die Rekonstitution erforderlich ist. Entsorgen Sie die Durchstechflasche mit dem Rest des Lösungsmittels.
- Führen Sie die 25 G-Belüftungsnadel oben in die Durchstechflasche mit Fluralaner-Pulver ein (Abbildung B).
- Während Sie die Durchstechflasche horizontal in der Hand drehen, geben Sie die 15 ml Lösungsmittel langsam in die Durchstechflasche mit Fluralaner-Pulver, um eine vollständige Benetzung des Pulvers zu gewährleisten (Abbildung C).
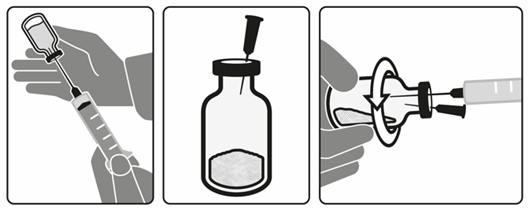
- Sobald das Lösungsmittel hinzugefügt wurde, entfernen Sie die Belüftungsnadel und die Transfernadel aus der Durchstechflasche mit Fluralaner-Pulver. Entsorgen Sie die Nadeln.
- Schütteln Sie die Durchstechflasche mindestens 30 Sekunden lang kräftig, bis sich eine gründlich gemischte Suspension gebildet hat. Das rekonstituierte Produkt ist eine undurchsichtige, weiße bis blassgelbe, leicht viskose Suspension, die praktisch frei von Konglomeraten ist.
- Das auf dem Etikett der Durchstechflasche aufgedruckte Verfallsdatum bezieht sich auf das Pulver, wie es für den Verkauf verpackt ist. Nach der Rekonstitution muss die Suspension spätestens nach 3 Monaten ab dem Datum der Rekonstitution verworfen werden. Schreiben Sie das Entsorgungsdatum auf das Etikett der Durchstechflasche aus Glas.
Art der Verabreichung der rekonstituierten Suspension in den Hund:
- Bestimmen Sie die zu verabreichende Dosis basierend auf dem Körpergewicht des Hundes.
- Verwenden Sie zur Verabreichung eine sterile Spritze und eine sterile 18 G-Nadel.
- Das Fluralaner-Pulver setzt sich beim Stehen von der Suspension ab. Schütteln Sie die rekonstituierte Durchstechflasche vor jedem Gebrauch 30 Sekunden lang kräftig, um eine gleichmäßige Suspension zu erhalten.
- Es kann erforderlich sein, vor der Dosierung Luft in die Durchstechflasche zu injizieren.
- Um eine gleichmäßige Suspension und eine genaue Dosierung zu gewährleisten, sollte die Dosis innerhalb von ca. 5 Minuten nach dem Aufziehen in die Dosierspritze verabreicht werden.
- Injizieren Sie das Produkt subkutan, z.B. in den dorso-scapularen Bereich.
Durchstechen Sie den Stopfen der Durchstechflasche mit der rekonstituierten Suspension nicht mehr als 20 Mal.
Zur Rekonstitution nach dem Abstellen die Durchstechflasche mindestens 30 Sekunden lang kräftig schütteln, um eine gleichmäßige Suspension zu erhalten.
Behandlungsplan
Bei einem Befall mit Flöhen und Zecken sollten die Notwendigkeit und Häufigkeit von Wiederholungsbehandlungen auf tierärztlicherBeratung beruhen und die lokale epidemiologische Situation und die Lebensweise des Tieres berücksichtigen. Die Behandlung mit diesem Tierarzneimittel kann zu jeder Jahreszeit beginnen und ohne Unterbrechung fortgesetzt werden. Siehe auch Abschnitt „Besondere Warnhinweise“.
Wartezeiten
Nicht zutreffend.
Besondere Lagerungshinweise
Arzneimittel unzugänglich für Kinder aufbewahren.
Für dieses Tierarzneimittel sind in der Originalverpackung bezüglich der Temperatur keine besonderen Lagerungsbedingungen erforderlich.
Nach der Rekonstitution unter 30 °C lagern.
Sie dürfen dieses Tierarzneimittel nach dem auf dem Etikett angegebenen Verfalldatum nach „Exp.“ nicht mehr anwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats.
Haltbarkeit nach Rekonstitution gemäß den Anweisungen: 3 Monate
Besondere Vorsichtsmaßnahmen für die Entsorgung
Arzneimittel sollten nicht über das Abwasser oder den Haushaltsabfall entsorgt werden.
Das Tierarzneimittel darf nicht in Gewässer gelangen, da Fluralaner eine Gefahr für aquatische Invertebraten darstellen kann.
Nutzen Sie Rücknahmesysteme für die Entsorgung nicht verwendeter Tierarzneimittel oder daraus entstandener Abfälle nach den örtlichen Vorschriften und die für das betreffende Tierarzneimittel geltenden nationalen Sammelsysteme. Diese Maßnahmen dienen dem Umweltschutz.
Einstufung von Tierarzneimitteln
Tierarzneimittel, das der Verschreibungspflicht unterliegt.
Zulassungsnummern und Packungsgrößen
EU/2/13/158/032-035
Jede Faltschachtel enthält 1, 2, 5 oder 10 Durchstechflasche(n) mit Pulver, Durchstechflasche(n) mit Lösungsmittel und sterile Belüftungsnadel(n).
Es werden möglicherweise nicht alle Packungsgrößen in Verkehr gebracht.
Datum der letzten Überarbeitung der Packungsbeilage
08/01/2024
Detaillierte Angaben zu diesem Tierarzneimittel sind in der Produktdatenbank der Europäischen Union verfügbar (https://medicines.health.europa.eu/veterinary).
Weitere Informationen
Das Tierarzneimittel trägt in Bereichen, zu denen behandelte Hunde Zugang haben, zur Kontrolle der Flohpopulation in der Umwelt bei.
I. ricinus- und D. reticulatus-Zecken, die bereits vor der Verabreichung des Tierarzneimittels auf dem Hund waren, werden innerhalb von 72 Stunden abgetötet. R. sanguineus-Zecken, die bereits vor der Verabreichung des Tierarzneimittels auf dem Hund waren, werden innerhalb von 96 Stunden abgetötet. Neu auftretende Zecken werden eine Woche bis 12 Monate nach der Behandlung innerhalb von 48 Stunden abgetötet.
Flöhe, die sich bereits vor der Verabreichung des Tierarzneimittels am Hund befinden, werden innerhalb von 48 Stunden abgetötet. Neu auftretende Flöhe werden eine Woche bis 12 Monate nach der Behandlung innerhalb von 24 Stunden abgetötet.
Loggen Sie sich bei Connect ein, um die Mischanleitung im Video zu sehen:
