Bravecto® Plus Spot-on Katze

Lösung zum Auftropfen auf die Haut für Katzen
Bezeichnung des Tierarzneimittels
Bravecto Plus 112,5 mg / 5,6 mg Lösung zum Auftropfen auf die Haut für kleine Katzen (1,2 – 2,8 kg)
Bravecto Plus 250 mg / 12,5 mg Lösung zum Auftropfen auf die Haut für mittelgroße Katzen (>2,8 – 6,25 kg)
Bravecto Plus 500 mg / 25 mg Lösung zum Auftropfen auf die Haut für große Katzen (>6,25 – 12,5 kg)
Zusammensetzung
Wirkstoffe:
Jeder ml Lösung enthält 280 mg Fluralaner und 14 mg Moxidectin.
Jede Pipette ergibt:
| BRAVECTO PLUS Lösung zum Auftropfen auf die Haut | Pipetteninhalt (ml) | Fluralaner (mg) | Moxidectin (mg) |
| für kleine Katzen 1,2 – 2,8 kg | 0,4 | 112,5 | 5,6 |
| für mittelgroße Katzen >2,8 – 6,25 kg | 0,89 | 250 | 12,5 |
| für große Katzen >6,25 – 12,5 kg | 1,79 | 500 | 25 |
Sonstige Bestandteile:
| Qualitative Zusammensetzung sonstiger Bestandteile und anderer Bestandteile | Quantitative Zusammensetzung, falls diese Information für die ordnungsgemäße Verabreichung des Tierarzneimittels wesentlich ist |
| Aceton | |
| Butylhydroxytoluol | 1,07 mg/ml |
| Diethyltoluamid (DEET) | |
| Dimethylacetamid | |
| Tetraglycol |
Lösung zum Auftropfen auf die Haut.
Klare farblose bis gelbe Lösung.
Zieltierart(en)
Katzen
Anwendungsgebiet(e)
Für Katzen mit bestehender parasitärer Mischinfektion durch Zecken oder Flöhe und Ohrmilben, gastrointestinale Nematoden, Herzwürmer oder Lungenwürmer oder bei Vorliegen eines entsprechenden Gefährdungspotentials. Das Tierarzneimittel ist nur angezeigt, wenn eine gleichzeitige Anwendung gegen Zecken oder Flöhe und gegen einen oder mehrere der anderen Zielparasiten erforderlich ist.
Zur Behandlung eines Zecken- und Flohbefalls bei Katzen mit sofortiger und anhaltender abtötender Wirkung gegen Flöhe (Ctenocephalides felis) und Zecken (Ixodes ricinus) über 12 Wochen.
Flöhe und Zecken müssen am Wirt anheften und mit der Nahrungsaufnahme beginnen, um dem Wirkstoff ausgesetzt zu werden.
Das Tierarzneimittel kann als Teil der Behandlungsstrategie gegen die allergische Flohdermatitis (FAD) eingesetzt werden.
Zur Behandlung eines Befalls mit Ohrmilben (Otodectes cynotis).
Zur Behandlung von Infektionen mit intestinalen Spulwürmern (4. Larvalstadium, unreife adulte und adulte Stadien von Toxocara cati)und Hakenwürmern (4. Larvalstadium, unreife adulte und adulte Stadien von Ancylostoma tubaeforme).
Bei wiederholter Verabreichung in 12-wöchigem Abstand beugt das Tierarzneimittel kontinuierlich einer durch Dirofilaria immitis verursachten Herzwurmerkrankung vor (für weitergehende Informationen siehe Abschnitt 9).
Vorbeugung der Aelurostrongylose (durch Vermeidung der Ansiedlung von adulten Aelurostrongylus abstrusus, die für die klinische Erkrankung verantwortlich sind).
Gegenanzeigen
Nicht anwenden bei bekannter Überempfindlichkeit gegenüber den Wirkstoffen oder einem der sonstigen Bestandteile.
Besondere Warnhinweise
Besondere Warnhinweise:
Zecken und Flöhe müssen mit der Nahrungsaufnahme auf dem Wirt beginnen, um gegen Fluralaner exponiert zu werden. Deshalb kann ein Risiko der Übertragung von Krankheiten durch Parasiten nicht ausgeschlossen werden.
Katzen in Gebieten, in denen der Herzwurm endemisch ist (oder die in endemische Gebiete verreist waren), können mit adulten Herzwürmern befallen sein. Gegen adulte Dirofilaria immitis ist keine therapeutische Wirksamkeit belegt. Es wird daher in Übereinstimmung mit der guten veterinärmedizinischen Praxis empfohlen, Tiere im Alter von 6 Monaten oder älter, die in Gebieten leben, in denen ein Vektor vorkommt, auf eine bestehende Infektion mit adultem Herzwurm zu testen, bevor das Tierarzneimittel zur Vorbeugung der Herzwurmerkrankung aufgetragen wird.
Zur Vorbeugung der Herzwurmerkrankung bei Katzen, die vorübergehend in endemischen Gebieten sind, sollte das Tierarzneimittel vor dem ersten möglichen Kontakt mit Mücken aufgetragen werden und sollte bis zur Rückkehr in nicht-endemische Gebiete alle 12 Wochen angewendet werden. Die Dauer zwischen der Behandlung und der Rückkehr aus endemischen Gebieten sollte 60 Tage nicht überschreiten.
Für die Behandlung von Infektionen mit Ohrmilben (Otodectes cynotis) oder den gastrointestinalen Nematoden T. cati und A. tubaeforme sollten vom verschreibenden Tierarzt die Notwendigkeit und Häufigkeit einer Wiederholungsbehandlung sowie die Auswahl der Behandlung (Mono- oder Kombinationspräparat) festgelegt werden.
Eine unnötige oder von den Vorgaben in der Fachinformation abweichende Anwendung von Antiparasitika kann den Resistenzselektionsdruck erhöhen und zu einer verminderten Wirksamkeit führen. Die Entscheidung über die Anwendung des Tierarzneimittels sollte für jedes einzelne Tier aufgrund des Nachweises der Parasitenspezies und der Befallsstärke oder des Risikos für eine Infektion basierend auf deren epidemiologischen Merkmalen getroffen werden.
Die häufige, wiederholte Anwendung eines Anthelminthikums einer bestimmten Substanzgruppe kann zur Resistenz von Parasiten gegenüber Anthelminthika dieser Substanzgruppe führen. Eine Parasitenbekämpfung wird für die gesamte Periode des möglichen Infektionsrisikos empfohlen.
Die Möglichkeit, dass andere im gleichen Haushalt lebende Tiere eine Quelle für eine Reinfektion mit Flöhen, Ohrmilben oder gastrointestinalen Nematoden sein können, sollte bedacht werden. Diese Tiere sollten sofern erforderlich mit einem geeigneten Tierarzneimittel behandelt werden.
Häufiges Schwimmen oder Schamponieren des Tieres vermeiden, da ein Erhalt der Wirksamkeit unter diesen Bedingungen nicht getestet wurde.
Besondere Vorsichtsmaßnahmen für die sichere Anwendung bei den Zieltierarten:
Es ist darauf zu achten, dass es nicht zu einem Kontakt mit den Augen des Tieres kommt.
Nicht direkt auf Hautverletzungen auftragen.
Da entsprechende Daten nicht vorliegen, wird die Anwendung dieses Tierarzneimittels bei Katzenwelpen unter einem Alter von 9 Wochen und bei Katzen mit einem Gewicht unter 1,2 kg nicht empfohlen.
Eine Behandlung von männlichen Zuchttieren wird nicht empfohlen.
Dieses Tierarzneimittel ist zum Auftropfen auf die Haut bestimmt und sollte nicht oral verabreicht werden.
Eine orale Aufnahme des Tierarzneimittels in der maximal empfohlenen Dosis von 93 mg Fluralaner + 4,65 mg Moxidectin /kg Körpergewicht wurde von Katzen mit Ausnahme von vorübergehendem Speicheln oder vereinzelten Fällen von Erbrechen unmittelbar nach der Verabreichung gut vertragen.
Es ist wichtig, die Dosis wie vorgesehen zu verabreichen, um das Tier am Ablecken und der Aufnahme des Tierarzneimittels zu hindern (siehe Abschnitte 7 und 9).
Verhindern Sie, dass kürzlich behandelte Tiere sich gegenseitig belecken.
Behandelten Tieren den Kontakt mit nicht behandelten Tieren verwehren, bis die Applikationsstelle trocken ist.
Besondere Vorsichtsmaßnahmen für den Anwender:
Kontakt mit dem Tierarzneimittel sollte vermieden werden und es müssen die am Abgabeort mit diesem Tierarzneimittel erhaltenen Einweg-Schutzhandschuhe beim Umgang mit dem Tierarzneimittel aus folgenden Gründen getragen werden:
Überempfindlichkeitsreaktionen, die möglicherweise schwerwiegend sein können, wurden bei einer kleinen Anzahl Personen berichtet.
Personen mit einer Überempfindlichkeit gegenüber Fluralaner oder einem der sonstigen Bestandteile sollten jeglichen Kontakt mit dem Tierarzneimittel meiden.
Das Tierarzneimittel haftet auf der Haut und kann nach versehentlichem Verschütten auch an Oberflächen binden.
Hautausschläge, Kribbeln oder Taubheitsgefühle wurde bei einer kleinen Anzahl von Personen nach Hautkontakt berichtet.
Bei Hautkontakt, die betroffene Stelle sofort mit Seife und Wasser waschen. In manchen Fällen reichen Seife und Wasser nicht aus, um ausgelaufenes Tierarzneimittel von den Fingern zu entfernen.
Kontakt mit dem Tierarzneimittel kann auch beim Umgang mit einem behandelten Tier entstehen. Vergewissern Sie sich, dass die Applikationsstelle bei Ihrem Tier nicht mehr erkennbar ist, bevor Sie diese wieder berühren. Dies bezieht sich auch auf das Kuscheln oder den Aufenthalt im gleichen Bett mit dem Tier. Es dauert bis zu 48 Stunden bis die Applikationsstelle trocken wird, dennoch wird sie länger erkennbar bleiben.
Sollten Hautreaktionen auftreten, ziehen Sie einen Arzt zu Rate und zeigen ihm die Verpackung des Tierarzneimittels.
Personen mit einer empfindlichen Haut oder allgemein bekannter Allergie, z.B. gegen andere Tierarzneimittel aus dieser Klasse, sollten im Umgang mit diesem Tierarzneimittel und den damit behandelten Tieren vorsichtig sein.
Dieses Tierarzneimittel kann Augenreizungen verursachen. Im Falle eines Augenkontaktes sofort mit reichlich Wasser spülen.
Das Tierarzneimittel ist bei oraler Aufnahme schädlich. Bewahren Sie das Tierarzneimittel bis zur Anwendung in der Originalverpackung auf, um Kindern den direkten Zugriff zu verwehren. Eine gebrauchte Pipette sollte sofort entsorgt werden. Bei versehentlicher Einnahme ist ein Arzt zu Rate zu ziehen und die Packungsbeilage oder das Etikett vorzuzeigen.
Das Tierarzneimittel ist leicht entflammbar. Von Hitze, Funken, offenem Feuer oder anderen Zündquellen fernhalten.
Versehentliche Spritzer beispielsweise auf einen Tisch oder den Fußboden mit einem Papiertuch entfernen und die Fläche mit einem Reinigungsmittel säubern.
Trächtigkeit und Laktation:
Die Unbedenklichkeit des Tierarzneimittels bei trächtigen und laktierenden Katzen wurde nicht untersucht, weshalb die Anwendung bei solchen Tieren nicht empfohlen wird.
Wechselwirkung mit anderen Arzneimitteln und sonstige Wechselwirkungen:
Für makrozyklische Laktone einschließlich Moxidectin wurde gezeigt, dass sie Substrate für P-Glykoprotein sind. Daher sollten während der Behandlung mit diesem Tierarzneimittel andere Tierarzneimittel, die P-Glykoprotein hemmen können (z.B. Cyclosporin, Ketoconazol, Spinosad, Verapamil) nur nach entsprechender Nutzen-Risiko-Bewertung durch den behandelnden Tierarzt zeitgleich angewandt werden.
Überdosierung:
Nach äußerlicher Verabreichung des bis zu 5-Fachen der maximal empfohlenen Dosis (93 mg Fluralaner + 4,65 mg Moxidectin, 279 mg Fluralaner + 13,95 mg Moxidectin und 465 mg Fluralaner + 23,25 mg Moxidectin/kg Körpergewicht) zu 3 Zeitpunkten in kürzeren Abständen als empfohlen (8-Wochen-Intervalle) wurden bei 9 – 13 Wochen alten Katzenwelpen mit Körpergewichten von 0,9 – 1,9 kg keine Nebenwirkungen beobachtet.
Nebenwirkungen
Katzen:
| Häufig (1 bis 10 Tiere / 100 behandelte Tiere): | Hautreaktionen an der Applikationsstelle (Haarausfall an der Applikationsstelle, schuppende Haut, Rötung an der Applikationsstelle und Juckreiz an der Applikationsstelle)#. |
| Gelegentlich (1 bis 10 Tiere / 1 000 behandelte Tiere): | Atemnot (nach Ablecken der Applikationsstelle), erhöhte Atemfrequenz; vermehrtes Speicheln, Erbrechen, blutiges Erbrechen, Durchfall; Teilnahmslosigkeit, Fieber; Pupillenerweiterung |
| Sehr selten (< 1 Tier/10 000 behandelte Tiere, einschließlich Einzelfallberichte): | Anorexie; neurologische Störungen (z.B. Tremor, Ataxie) |
# mild und vorübergehend
Die Meldung von Nebenwirkungen ist wichtig. Sie ermöglicht die kontinuierliche Überwachung der Verträglichkeit eines Tierarzneimittels. Falls Sie Nebenwirkungen, insbesondere solche, die nicht in der Packungsbeilage aufgeführt sind, bei Ihrem Tier feststellen, oder falls Sie vermuten, dass das Tierarzneimittel nicht gewirkt hat, teilen Sie dies bitte zuerst Ihrem Tierarzt mit. Sie können Nebenwirkungen auch an den Zulassungsinhaber unter Verwendung der Kontaktdaten am Ende dieser Packungsbeilage oder über Ihr nationales Meldesystemmelden.
Dosierung für jede Tierart, Art und Dauer der Anwendung
Zum Auftropfen auf die Haut.
Das Tierarzneimittel ist in 3 Pipettengrößen erhältlich. Die nachfolgende Tabelle bestimmt die für das Körpergewicht der Katze zu verwendende Pipettengröße (entsprechend einer Dosis von 40 – 94 mg Fluralaner/kg Körpergewicht und 2 – 4,7 mg Moxidectin/kg Körpergewicht):
| Körpergewicht der Katze (kg) | anzuwendende Pipettengröße |
| 1,2 – 2,8 | Bravecto Plus 112,5 mg / 5,6 mg Lösung zum Auftropfen auf die Haut für kleine Katzen |
| >2,8 – 6,25 | Bravecto Plus 250 mg / 12,5 mg Lösung zum Auftropfen auf die Haut für mittelgroße Katzen |
| >6,25 – 12,5 | Bravecto Plus 500 mg / 25 mg Lösung zum Auftropfen auf die Haut für große Katzen |
Innerhalb eines Gewichtsbereiches sollte jeweils der gesamte Inhalt einer Pipette verwendet werden.
Für Katzen mit mehr als 12,5 kg Körpergewicht die Kombination zweier Pipetten verwenden, die das Körpergewicht am besten abdeckt.
Unterdosierung kann zu einer unzureichenden Wirkung führen und kann eine Resistenzentwicklung begünstigen.
Hinweise für die richtige Anwendung
Zum Auftropfen auf die Haut.
Art der Anwendung
Schritt 1: Unmittelbar vor dem Gebrauch die Umverpackung öffnen und die Pipette herausnehmen. Handschuhe anziehen. Die Pipette am Ende oder am festen Teil unterhalb der Kappe in einer aufrechten Position halten, um sie zu öffnen. Die Kappe der Pipette im Uhrzeiger- oder Gegenuhrzeigersinn in einer vollständigen Umdrehung drehen. Die Kappe bleibt auf der Pipette, es ist nicht möglich, diese zu entfernen. Die Pipette ist offen und bereit für den Gebrauch, wenn ein Bruch der Versiegelung verspürt wird.

Schritt 2: Die Katze soll während der Anwendung stehen oder mit dem Rücken nach oben liegen. Die Pipettenspitze an die Schädelbasis der Katze halten.
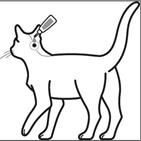
Schritt 3: Die Pipette sanft ausdrücken und den gesamten Inhalt direkt auf die Haut der Katze auftragen. Das Tierarzneimittel sollte bei Katzen mit einem Körpergewicht von bis zu 6,25 kg an einer Stelle, bei Katzen mit einem Körpergewicht über 6,25 kg an zwei Stellen an der Schädelbasis aufgetragen werden.
Behandlung
Für die gleichzeitige Behandlung von Infektionen mit Ohrmilben (Otodectes cynotis) sollte eine einmalige Dosis des Tierarzneimittels angewendet werden. Fragen sie nach einer weiteren tierärztlichen Untersuchung (z.B. Otoskopie) 28 Tage nach der Behandlung, um festzustellen, ob eine Reinfestation vorliegt, die eine zusätzliche Behandlung erfordern würde. Die Entscheidung über eine weitere Behandlung (Mono- oder Kombinationspräparat) ist vom verschreibenden Tierarzt zu treffen.
Für die gleichzeitige Behandlung von Infektionen mit den gastrointestinalen Nematoden T. cati und A. tubaeforme sollte eine Einzeldosis des Tierarzneimittels aufgetragen werden. Notwendigkeit und Häufigkeit einer Wiederholungsbehandlung sollten auf einem professionellen Rat basieren und sollten die lokale epidemiologische Situation und die Lebensumstände des Tieres berücksichtigen.
Wo erforderlich, können Katzen in Abständen von 12 Wochen behandelt werden.
Katzen in Gebieten, in denen der Herzwurm endemisch ist oder die in endemische Gebiete verreist waren, können mit adulten Herzwürmern befallen sein. Deshalb sollte vor dem Auftragen des Tierarzneimittels, sofern es zur gleichzeitigen Verhinderung einer Infektion mit adulten D. immitis Anwendung findet, der Hinweis in Abschnitt 6 berücksichtigt werden.
Zum Zeitpunkt der Anwendung ist das Tierarzneimittel wirksam gegen D. immitis Larven (L3 und L4), die das Tier in den 30 zurückliegenden Tagen befallen haben.
Das Tierarzneimittel ist gegen D. immitis Larven (L3) über einen Zeitraum von 60 Tagen nach der Anwendung wirksam. Deshalb müssen Katzen zur lückenlosen Vorbeugung der Herzwurmerkrankung in 12-Wochen-Abständen behandelt werden.
Zur Verhinderung der Ansiedlung von adulten Lungenwürmern, die für die klinische Aelurostrongylose verantwortlich sind, müssen Katzen in 12-Wochen-Abständen erneut behandelt werden.
Wartezeit(en)
Nicht zutreffend.
Besondere Lagerungshinweise
Arzneimittel unzugänglich für Kinder aufbewahren.
Für dieses Tierarzneimittel sind bezüglich der Temperatur keine besonderen Lagerungsbedingungen erforderlich. Die Pipetten sollten in den Beuteln aufbewahrt werden, um einen Lösungsmittelverlust oder eine Feuchtigkeitsaufnahme zu vermeiden. Die Beutel sollten erst unmittelbar vor Gebrauch geöffnet werden.
Sie dürfen dieses Tierarzneimittel nach dem auf dem Karton angegebenen Verfalldatum nach „Exp.“ nicht mehr anwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats.
Besondere Vorsichtsmaßnahmen für die Entsorgung
Arzneimittel sollten nicht über das Abwasser oder den Haushaltsabfall entsorgt werden.
Das Tierarzneimittel darf nicht in Gewässer gelangen, da Fluralaner and Moxidectin eine Gefahr für Fische und andere Wasserorganismen darstellen kann.
Nutzen Sie Rücknahmesysteme für die Entsorgung nicht verwendeter Tierarzneimittel oder daraus entstandener Abfälle nach den örtlichen Vorschriften und die für das betreffende Tierarzneimittel geltenden nationalen Sammelsysteme.
Diese Maßnahmen dienen dem Umweltschutz.
Fragen Sie Ihren Tierarzt oder Apotheker, wie nicht mehr benötigte Arzneimittel zu entsorgen sind.
Einstufung von Tierarzneimitteln
Tierarzneimittel, das der Verschreibungspflicht unterliegt.
Zulassungsnummern und Packungsgrößen
EU/2/18/224/001-006
Jede Schachtel enthält 1 oder 2 Pipetten und ein Paar Handschuhe pro Pipette.
Es werden möglicherweise nicht alle Packungsgrößen in Verkehr gebracht.
Datum der letzten Überarbeitung der Packungsbeilage
31/03/2023
Detaillierte Angaben zu diesem Tierarzneimittel sind in der Produktdatenbank der Europäischen Union verfügbar (https://medicines.health.europa.eu/veterinary).
Weitere Informationen
Das Tierarzneimittel trägt in Bereichen, zu denen behandelte Katzen Zugang haben, zur Kontrolle der Flohpopulation in der Umwelt bei.
Die Wirkung (abtötende Wirkung) gegen Zecken (I. ricinus) und Flöhe (C. felis) setzt innerhalb von 48 Stunden nach Behandlung ein.
