Finadyne® Transdermal 50 mg/ml Lösung
Lösung zum Übergießen für Rinder
Zusammensetzung
Jeder ml enthält:
Wirkstoff:
Flunixin 50 mg
entsprechend 83 mg Flunixin-Meglumin
Sonstige Bestandteile, deren Kenntnis für eine zweckgemäße Verabreichung des Mittels erforderlich ist:
Levomenthol: 50 mg
Allurarot (E129): 0,2 mg
Klare, rote Flüssigkeit ohne Trübung und sichtbare Partikel.
Zieltierart(en)
Rind
Anwendungsgebiet(e)
Zur Fiebersenkung in Verbindung mit Atemwegserkrankungen bei Rindern.
Zur Fiebersenkung in Verbindung mit akuter Mastitis bei Rindern.
Zur Verminderung von Schmerz und Lahmheit in Verbindung mit interdigitaler Phlegmone, Dermatitis interdigitalis und Dermatitis digitalis (Mortellaro).
Gegenanzeigen
Nicht anwenden bei Tieren mit Herz-, Leber- oder Nierenerkrankungen, oder wenn die Gefahr einer gastrointestinalen Ulzeration oder Blutungsneigung besteht.
Nicht bei stark dehydrierten, hypovolämischen Tieren anwenden, da ein mögliches Risiko für eine erhöhte Nierentoxizität besteht.
Das Tierarzneimittel nicht bei trächtigen Kühen in den letzten 48 Stunden vor dem erwarteten Abkalbetermin anwenden.
Nicht anwenden bei Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile.
Besondere Warnhinweise
Besondere Warnhinweise:
Nur auf trockene Haut auftragen und mindestens bis 6 Stunden nach der Applikation vor Nässeeinfluss schützen.
Im Falle bakterieller Infektionen sollte eine zeitgleiche antibiotische Therapie erwogen werden.
Besondere Vorsichtsmaßnahmen für die sichere Anwendung bei den Zieltierarten:
Von nichtsteroidalen Antiphlogistika (NSAIDs) ist bekannt, dass sie infolge einer tokolytischen Wirkung die Geburt verzögern können, indem sie Prostaglandine hemmen, die eine wichtige Funktion bei der Auslösung der Geburt haben. Die Anwendung des Tierarzneimittels sofort nach der Geburt kann die Rückbildung der Gebärmutter sowie das Ausstoßen der Eihäute stören, was eine Nachgeburtsverhaltung zur Folge hat.
Verträglichkeitsstudien bei Zuchtbullen wurden nicht durchgeführt. Laborstudien an Ratten ergaben keine Hinweise auf reproduktionstoxische Effekte. Nur nach einer Nutzen-Risiko-Abwägung des verantwortlichen Tierarztes anwenden.
Die Anwendung bei Saugkälbern und bei alten Tieren kann zusätzliche Risiken beinhalten. Falls eine solche Behandlung nicht vermieden werden kann, ist möglicherweise eine Reduzierung der Dosis sowie eine sorgfältige klinische Überwachung angezeigt.
Nur auf intakte Haut auftragen.
Flunixin ist toxisch für aasfressende Vögel. Nicht an Tiere verabreichen, die in die Nahrungskette von Wildtieren gelangen könnten.
Im Falle des Todes oder der Euthanasie behandelter Tiere ist sicherzustellen, dass diese nicht der Wildfauna zugänglich gemacht werden.
Besondere Vorsichtsmaßnahmen für den Anwender:
Nichtsteroidale Antiphlogistika (NSAIDs) können Überempfindlichkeitsreaktionen
(Allergien) verursachen. Personen mit bekannter Überempfindlichkeit gegenüber NSAIDs sollten den Kontakt mit dem Tierarzneimittel vermeiden. Das Tierarzneimittel verursacht schwere und irreversible Augenschädigungen und leichte Hautirritationen.
Ein Verschlucken des Tierarzneimittels oder ein Hautkontakt mit dem Tierarzneimittel kann schädlich sein. Vermeiden Sie den Kontakt mit Haut und Augen, einschließlich Hand-zu-Augenkontakt.
Vermeiden Sie den Kontakt der behandelten Stelle (damit eine Verteilung des Tierarzneimittels möglich ist) insbesondere ohne Schutzhandschuhe für mindestens 3 Tage oder bis zur Trocknung der Applikationsstelle (falls dies länger dauert).
Verhindern Sie, dass Kinder Zugang zum Tierarzneimittel beziehungsweise zu damit behandelten Tieren erhalten.
Bei der Handhabung des Tierarzneimittels sollte der Anwender eine Schutzausrüstung bestehend aus undurchlässigen Handschuhen, Schutzkleidung und einer geeigneten Schutzbrille tragen.
Im Falle einer versehentlichen Einnahme oder Kontakt mit dem Mund, den Mund sofort mit viel Wasser spülen, ärztlichen Rat einholen. und dabei dem Arzt die Packungsbeilage oder das Etikett zeigen.
Bei Augenkontakt, die Augen sofort mit reichlich sauberem Wasser spülen und ärztlichen Rat einholen.
Bei Hautkontakt gründlich mit Seife und Wasser waschen.
Während der Anwendung des Tierarzneimittels nicht rauchen, essen oder trinken.
Nach der Anwendung Hände waschen.
Trächtigkeit und Laktation:
Kann mit Ausnahme der letzten 48 Stunden vor der Geburt während der Trächtigkeit und während der Laktation angewandt werden.
Bei der Anwendung des Tierarzneimittels innerhalb der ersten 36 Stunden nach der Geburt kann es zu einem vermehrten Auftreten von Nachgeburtsverhaltungen kommen. Das Tierarzneimittel sollte daher in den ersten 36 Stunden nach der Geburt nur nach einer Nutzen-Risiko-Abwägung des verantwortlichen Tierarztes verabreicht werden. Behandelte Tiere sollten außerdem in Hinblick auf eine Nachgeburtsverhaltung überwacht werden.
Wechselwirkung mit anderen Arzneimitteln und sonstige Wechselwirkungen:
Nicht gleichzeitig oder innerhalb von 24 Stunden mit anderen NSAIDs anwenden.
Einige NSAIDs weisen eine hohe Plasma-Eiweißbindung auf und konkurrieren mit anderen hoch an Plasma-Eiweiß gebundenen Arzneimitteln, wodurch toxische Wirkungen auftreten können. Die gleichzeitige Verabreichung potenziell nephrotoxischer Substanzen sollte vermieden werden.
Überdosierung:
Lokalisierte Entzündungsreaktionen und Nekrosen der Haut wurden bei 5 mg/kg berichtet.
Erosive und ulzerative Läsionen im Labmagen wurden bei Tieren beobachtet, die mit dem Dreifachen der empfohlenen therapeutischen Dosis behandelt wurden. Okkultes fäkales Blut in den Fäzes wurde bei einigen Tieren beobachtet, die mit dem Fünffachen der empfohlenen therapeutischen Dosis behandelt wurden.
Notfallmaßnahmen sind nicht erforderlich.
Wesentliche Inkompatibilitäten:
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Tierarzneimittel nicht mit anderen Tierarzneimitteln gemischt werden.
Nebenwirkungen
Rind
| Häufig (1 bis 10 Tiere / 100 behandelte Tiere): |
| Schwellung an der Applikationsstelle1, Erythem (Rötung) an der Applikationsstelle1, trockene Haut (Schuppen) an der Applikationsstelle1, Veränderung des Haarkleides an der Applikationsstelle (abgebrochene/spröde Haare, dünnes Haar), Alopezie (Haarverlust) an der Applikationsstelle1, Hautverdickung an der Applikationsstelle1 Reizbarkeit2, Erregung2, gestörte Befindlichkeit2 |
| Sehr selten (< 1 Tier/10 000 behandelte Tiere, einschließlich Einzelfallberichte): |
| Anaphylaxie3 |
1 Diese Veränderungen wurden als vorübergehend gemeldet. Im Allgemeinen ist keine spezifische Behandlung erforderlich.
2 Vorübergehende Symptome
3 Kann schwerwiegend sein, kann auftreten und sollte symptomatisch behandelt werden
Die Meldung von Nebenwirkungen ist wichtig. Sie ermöglicht die kontinuierliche Überwachung der Verträglichkeit eines Tierarzneimittels. Falls Sie Nebenwirkungen, insbesondere solche, die nicht in der Packungsbeilage aufgeführt sind, bei Ihrem Tier feststellen, oder falls Sie vermuten, dass das Tierarzneimittel nicht gewirkt hat, teilen Sie dies bitte zuerst Ihrem Tierarzt mit. Sie können Nebenwirkungen auch an den Zulassungsinhaber unter Verwendung der Kontaktdaten am Ende dieser Packungsbeilage oder über Ihr nationales Meldesystem melden.
Dosierung für jede Tierart, Art und Dauer der Anwendung
Zum Übergießen. Zur einmaligen Anwendung. Die empfohlene Behandlungsdosis beträgt 3,33 mg Flunixin/kg Körpergewicht (entsprechend 1 ml/15 kg Körpergewicht). Die Dosierkammer der Flasche ist nach Kilogramm Körpergewicht kalibriert. Um eine korrekte Dosierung zu gewährleisten, sollte das Körpergewicht so genau wie möglich ermittelt werden.
Hinweise für die richtige Anwendung
Machen Sie sich mit den Anwendungshinweisen intensiv vertraut, bevor die Tiere behandelt werden, um die Handhabung des Behältnisses sicher zu beherrschen.
Bedienungsanleitung
| Schritt 1: Vor der ersten Anwendung Verschlusskappe von der Dosierkammer abschrauben und das abziehbare Siegel entfernen. | Nicht die Kappe der Flasche abschrauben.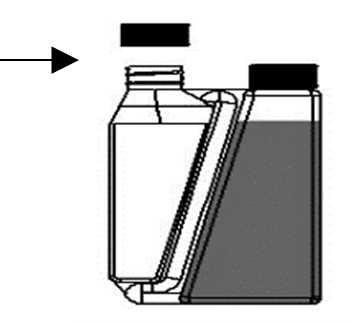 |
| Schritt 2: Flasche aufrecht und auf Augenhöhe halten. Dann langsam und sanft die Flasche drücken, um die Dosierkammer bis zur gewünschten Markierung zu füllen. Bei Überfüllung der Dosierkammer Anweisung zur Behebung einer Überfüllung befolgen. | Dosierkammer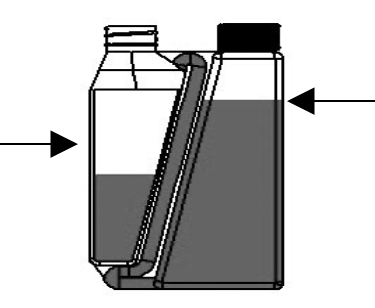 |
| Schritt 3: Das abgemessene Volumen entlang der Rückenlinie des Tieres vom Widerrist bis zur Schwanzwurzel aufgießen. Eine kleine Flüssigkeitsmenge bleibt in den Wänden der Kammer zurück. Die Kalibrierung der Kammer berücksichtigt dies. Das Drücken der Flasche während des Ausgießens der Lösung aus der Dosierkammer vermeiden. | 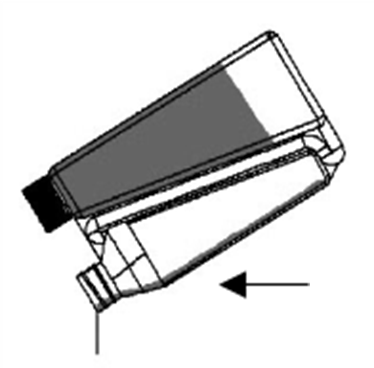 |
Anweisung zur Behebung einer Überfüllung
| Schritt 1: Verschlusskappe auf Dosierkammer setzen und zuschrauben. | Verschlusskappe auf Flasche setzen und zuschrauben (sofern erforderlich)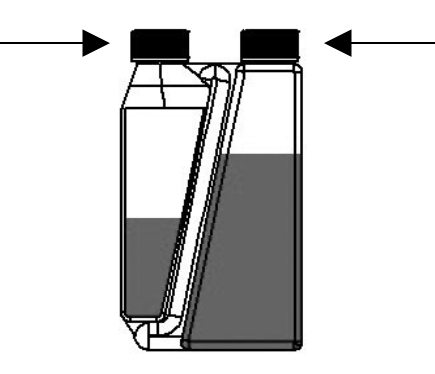 |
| Schritt 2: Die Flasche so schwenken, dass innerhalb der Flasche am Beginn des Transferröhrchens ein Luftraum entsteht. | Transferröhrchen (oberer Pfeil) Luftraum (unterer Pfeil) 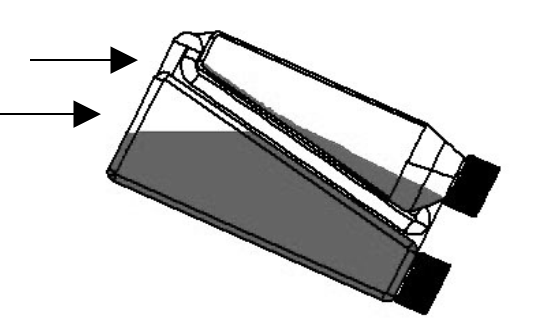 |
| Schritt 3: Die Flasche horizontal halten, damit das Tierarzneimittel das Ende des Transferröhrchens innerhalb der Dosierkammer bedeckt. | Transferröhrchen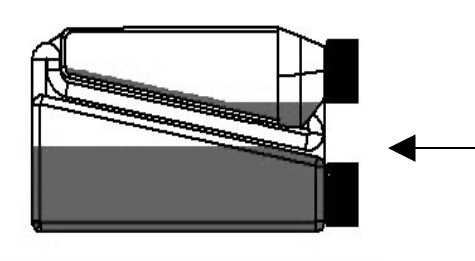 |
| Schritt 4: Die Flasche wiederholt drücken und wieder loslassen. Das Tierarzneimittel fließt durch das Transferröhrchen in die Flasche zurück. | 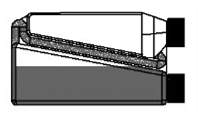 |
Abbildung 1 – Empfohlener Bereich für das Aufgießen
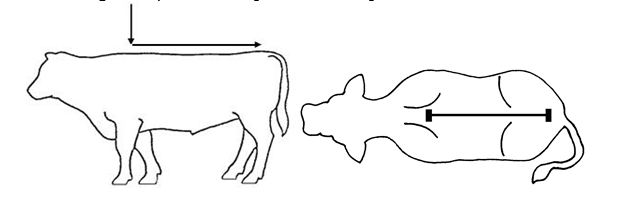
Wartezeiten
Essbare Gewebe: 7 Tage.
Milch: 36 Stunden.
Wegen der möglichen Kreuzkontamination von unbehandelten Tieren mit diesem Tierarzneimittel bei der Fellpflege (Ablecken) sollten behandelte Tiere über die gesamte Wartezeit von den unbehandelten Tieren separiert werden. Die Nichteinhaltung dieser Empfehlung kann zu Rückständen bei unbehandelten Tieren führen.
Besondere Lagerungshinweise
Arzneimittel unzugänglich für Kinder aufbewahren.
Für dieses Tierarzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Sie dürfen dieses Tierarzneimittel nach dem auf der Flasche angegebenen Verfalldatum nicht mehr anwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats.
Haltbarkeit nach dem ersten Öffnen/Anbruch des Behältnisses: 6 Monate. Auf dem Etikett befindet sich eine Stelle, an der das Datum, zu dem Reste des Tierarzneimittels zu verwerfen sind, eingetragen werden kann.
Besondere Vorsichtsmaßnahmen für die Entsorgung
Arzneimittel sollten nicht über das Abwasser oder den Haushaltsabfall entsorgt werden. Nutzen Sie Rücknahmesysteme für die Entsorgung nicht verwendeter Tierarzneimittel oder daraus entstandener Abfälle nach den örtlichen Vorschriften und die für das betreffende Tierarzneimittel geltenden nationalen Sammelsysteme.
Einstufung von Tierarzneimitteln
Tierarzneimittel, das der Verschreibungspflicht unterliegt.
Zulassungsnummern und Packungsgrößen
Eine Flasche mit 100 ml, 250 ml oder 1 l.
Es werden möglicherweise nicht alle Packungsgrößen in Verkehr gebracht.
Z.Nr. 835578
Datum der letzten Überarbeitung der Packungsbeilage
06/2023
Detaillierte Angaben zu diesem Tierarzneimittel sind in der Produktdatenbank der Europäischen Union verfügbar (https://medicines.health.europa.eu/veterinary).
Weitere Informationen
Umweltverträglichkeit:
Flunixin ist toxisch für aasfressende Vögel, auch wenn die voraussichtlich geringe Exposition zu einem geringen Risiko führt.
Informationen für den behandelnden Tierarzt:
Der Wirkstoff Flunixin (als Meglumin-Salz) ist eine nichtsteroidale, entzündungshemmende Substanz (NSAID) mit Carbonsäure-Struktur, die nicht-narkotisch, schmerzlindernd und fiebersenkend wirkt. Flunixin besitzt eine starke Hemmwirkung auf das Cyclooxygenase-System (COX-1 und COX-2). Dieses Enzym wandelt Arachidonsäure in instabile zyklische Endoperoxide um, die in Prostaglandine, Prostacyclin und Thromboxan umgebaut werden. Die Hemmung der Bildung dieser Komponenten ist für die schmerzlindernde, fiebersenkende und entzündungshemmende Wirkung von Flunixin-Meglumin verantwortlich.
In einer Studie wurde die Wirksamkeit von Finadyne Transdermal zur Senkung der rektalen Temperatur bei 64 Kühen mit Mastitis untersucht und mit einer Placebo-Gruppe bestehend aus 66 Kühen verglichen. Sechs Stunden nach der Behandlung zeigten 95,3 % der Kühe, die mit Finadyne Transdermal behandelt wurden, eine Senkung der rektalen Temperatur um mehr als 1,1 °C im Vergleich zu 34,9 % in der Placebo-Gruppe. Nach einer zusätzlichen Antibiotika-Behandlung nach sechs Stunden bestand kein Unterschied mehr zwischen den beiden Gruppen.
Nach dermaler Verabreichung wird Flunixin bei Rindern mäßig über die Haut resorbiert (Bioverfügbarkeit ca. 44 %). Bei Rindern (Kälber ausgenommen) sind die Verteilungsvolumina wegen der hohen Bindung an Plasmaproteine (ungefähr 99 %) im Allgemeinen niedrig. Die scheinbare Halbwertszeit für die Elimination aus dem Plasma nach dem Aufgießen auf die Haut beträgt ca. 7,8 Stunden. Die Verstoffwechselung von Flunixin ist gering. Der überwiegende Anteil des Arzneimittels bleibt unverändert, die übrigen Metabolite resultieren aus Hydroxylierungen. Bei Rindern erfolgt die Ausscheidung überwiegend über die Galle.
Nach einer Behandlung durch Aufgießen wurde in wärmerer Umgebung eine im Vergleich zu einer kälteren Umgebung schnellere Resorption beobachtet. Unter warmen Bedingungen (Umgebungstemperaturen zwischen 13 °C und 30 °C) betrug die Tmax ungefähr 2 Stunden, während dieser Wert unter kalten Bedingungen (Umgebungstemperaturen zwischen -3 °C und 7 °C) bei ungefähr 6 Stunden lag.
Eine fiebersenkende Wirkung wurde ab 4 Stunden nach Verabreichung des Tierarzneimittels gezeigt.
Rezept- und apothekenpflichtig
