ShutOut®

Suspension zur intramammären Anwendung für trockenstehende Milchkühe
Bezeichnung des Tierarzneimittels
ShutOut 2,6 g Suspension zur intramammären Anwendung für trockenstehende Milchkühe
Zusammensetzung
Jeder Euterinjektor mit 4 g Suspension enthält:
Wirkstoff:
Schweres, basisches Bismutnitrat
(entsprechend Bismut
2,6 g
1,9 g)
Weiße bis leicht gelbe, homogene Suspension.
Zieltierart(en)
Rind (Milchkuh zum Zeitpunkt des Trockenstellens).
Anwendungsgebiet(e)
Zur Vorbeugung von Neuinfektionen des Euters während der Trockenstehzeit.
Bei Kühen, die als frei von subklinischer Mastitis beurteilt werden, kann das Tierarzneimittel beim Trockenstell-Management und zur Mastitiskontrolle alleine angewendet werden.
Gegenanzeigen
Nicht zur alleinigen Anwendung bei Kühen mit subklinischer Mastitis zum Zeitpunkt des Trockenstellens.
Nicht anwenden bei Kühen mit klinischer Mastitis zum Zeitpunkt des Trockenstellens.
Nicht anwenden bei laktierenden Kühen. Siehe Abschnitt „Besondere Warnhinweise“.
Nicht anwenden bei Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile.
Besondere Warnhinweise
Besondere Warnhinweise:
Die Auswahl der mit diesem Tierarzneimittel zu behandelnden Kühe sollte auf Grund einer tierärztlichen klinischen Untersuchung erfolgen. Als Beurteilungskriterien können dabei das Mastitisgeschehen und der Zellzahlverlauf der einzelnen Kühe, anerkannte Verfahren zum Nachweis einer subklinischen Mastitis oder eine bakteriologische Untersuchung dienen.
Besondere Vorsichtsmaßnahmen für die sichere Anwendung bei den Zieltierarten:
Es wird empfohlen, trockenstehende Kühe regelmäßig auf Anzeichen einer klinischen Mastitis zu untersuchen. Sollte sich in einem versiegelten Euterviertel eine klinische Mastitis entwickeln, so ist das betroffene Viertel vor einer geeigneten Therapie manuell auszumelken. Um das Risiko einer Kontamination zu verringern, den Injektor nicht in Wasser eintauchen.
Den Injektor nur einmal verwenden.
Bei der Verabreichung des Tierarzneimittels sind aseptische Arbeitstechniken streng einzuhalten, da das Tierarzneimittel keine antimikrobielle Wirkung besitzt.
Nach der Verabreichung dieses Tierarzneimittels dürfen keine weiteren intramammär anzuwendenden Tierarzneimittel appliziert werden.
Bei Kühen mit Verdacht auf subklinische Mastitis kann dieses Tierarzneimittel nach Verabreichung eines geeigneten antibiotischen Trockenstellers in das infizierte Euterviertel eingebracht werden.
Besondere Vorsichtsmaßnahmen für den Anwender:
Dieses Tierarzneimittel kann Haut- und Augenreizungen verursachen. Vermeiden Sie den Kontakt mit der Haut oder den Augen. Bei Haut- oder Augenkontakt den betroffenen Bereich gründlich mit Wasser abwaschen.
Bismutsalze wurden mit Überempfindlichkeitsreaktionen in Verbindung gebracht. Personen mit bekannter Überempfindlichkeit gegen Bismutsalze sollten den Kontakt mit dem Tierarzneimittel vermeiden. Sollten nach der Anwendung Symptome auftreten, ist ein Arzt zu Rate zu ziehen und die Packungsbeilage oder das Etikett vorzuzeigen.
Nach Gebrauch Hände waschen.
Desinfektionstücher:
Die Desinfektionstücher können aufgrund des Gehaltes von Isopropylalkohol Haut- und Augenreizungen verursachen. Vermeiden Sie Kontakt mit den Augen. Vermeiden Sie längeren Kontakt mit der Haut. Vermeiden Sie das Einatmen der Dämpfe. Das Tragen von Handschuhen kann Hautreizungen vermeiden. Nach Gebrauch Hände waschen.
Trächtigkeit:
Da das Tierarzneimittel nach intramammärer Verabreichung nicht resorbiert wird, kann es bei trächtigen Tieren angewendet werden. Nach der Kalbung kann der Verschlusspfropf beim ersten Saugen des Kalbes aufgenommen werden. Die orale Aufnahme des Tierarzneimittels ist sicher und verursacht beim Kalb keine Nebenwirkungen.
Laktation:
Das Tierarzneimittel ist für die Anwendung bei trockenstehenden Milchkühen vorgesehen. Bei versehentlicher Verabreichung an laktierende Kühe kann vorübergehend eine geringgradige (bis zweifache) Zellzahlerhöhung auftreten. In diesem Fall den Verschlusspfropfen manuell ausmelken. Zusätzliche Vorsichtsmaßnahmen sind nicht notwendig.
Wechselwirkung mit anderen Arzneimitteln und sonstige Wechselwirkungen:
In klinischen Versuchen wurde die Verträglichkeit eines vergleichbaren Zitzenversieglers, der schweres, basisches Bismutnitrat enthält, nur mit Cloxacillin-haltigen Trockenstellern untersucht.
Überdosierung:
Das Doppelte der empfohlenen Dosis wurde an Kühe verabreicht und ohne Nebenwirkungen vertragen.
Nebenwirkungen
Keine bekannt.
Die Meldung von Nebenwirkungen ist wichtig. Sie ermöglicht die kontinuierliche Überwachung der Verträglichkeit eines Tierarzneimittels. Falls Sie Nebenwirkungen, insbesondere solche, die nicht in der Packungsbeilage aufgeführt sind, bei Ihrem Tier feststellen, oder falls Sie vermuten, dass das Tierarzneimittel nicht gewirkt hat, teilen Sie dies bitte zuerst Ihrem Tierarzt mit.
Sie können Nebenwirkungen auch an den Zulassungsinhaber unter Verwendung der Kontaktdaten am Ende dieser Packungsbeilage oder über Ihr nationales Meldesystem an das Bundesamt für Sicherheit im Gesundheitswesen, Traisengasse 5, 1200 Wien, über das elektronische Veterinär-Meldeformular auf der Internetseite (https://www.basg.gv.at), per E-mail (basg-v-phv@basg.gv.at) oder per Post melden.
Dosierung für jede Tierart, Art und Dauer der Anwendung
Intramammäre Anwendung.
Den Inhalt eines Euterinjektors unmittelbar nach dem letzten Melken (beim Trockenstellen) in jedes Euterviertel einbringen.
Hinweise für die richtige Anwendung
Verwenden Sie das Tierarzneimittel nicht, wenn Sie zerbrochene Kappen oder andere sichtbare Anzeichen von Beschädigung feststellen.
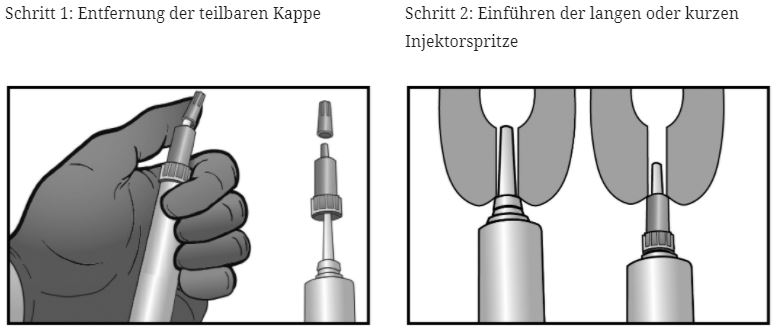
Das Tierarzneimittel hat eine zweigeteilte Kappe. Die Kappe des Injektors kann partiell oder ganz entfernt werden. Es wird empfohlen, die Zitze an der Zitzenbasis zusammenzudrücken. Dies hilft, die Suspension in die Zitzenzisterne zu applizieren und den Strichkanal von oben zu versiegeln.
Option mit kurzer Injektorspitze: Die kurze Injektorspitze erlaubt eine partielle Infusionstechnik, so dass die Spitze nur ins Zitzenende eingeführt werden muss.
Option mit langer Injektorspitze: Die lange Injektorspitze kann zur erleichterten Behandlung verwendet werden, beispielsweise um zu verhindern, dass die Spitze durch Bewegungen oder Nervosität der Kuh herausrutscht.
Nach dem Einbringen des Tierarzneimittels die Zitzen oder das Euter nicht massieren, da es wichtig ist, dass der Zitzenversiegler in der Zitze verbleibt und nicht in das Euter gelangt.
Um ein Infektionsrisiko nach der intramammären Verabreichung zu vermeiden, muss unbedingt darauf geachtet werden, dass keine Erreger über die Strichkanalöffnung eingebracht werden.
Es ist unbedingt notwendig, die Zitze sorgfältig mit den beigefügten alkoholischen Desinfektionstüchern zu säubern. Die Zitze sollte solange gereinigt werden, bis an den Tüchern keine Verunreinigungen mehr sichtbar sind. Vor dem Einbringen des Injektorinhaltes sollten die Zitzen trocken sein. Es ist darauf zu achten, die Injektorspitze nicht zu kontaminieren und unter aseptischen Bedingungen zu applizieren. Nach der Behandlung ist es ratsam, ein geeignetes Zitzendippmittel oder Spray zu verwenden.
Unter kalten Witterungsbedingungen kann das Tierarzneimittel in einer warmen Umgebung auf Raumtemperatur erwärmt werden, um das Instillieren zu erleichtern.
Wartezeiten
Essbare Gewebe: Null Tage.
Milch: Null Stunden.
Besondere Lagerungshinweise
Arzneimittel unzugänglich für Kinder aufbewahren.
Für dieses Tierarzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Sie dürfen das Tierarzneimittel nach dem auf dem Etikett angegebenen Verfalldatum nicht mehr anwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats.
Besondere Vorsichtsmaßnahmen für die Entsorgung
Arzneimittel sollten nicht über das Abwasser oder den Haushaltsabfall entsorgt werden.
Nutzen Sie Rücknahmesysteme für die Entsorgung nicht verwendeter Tierarzneimittel oder daraus entstandener Abfälle nach den örtlichen Vorschriften und die für das betreffende Tierarzneimittel geltenden nationalen Sammelsysteme.
Diese Maßnahmen dienen dem Umweltschutz.
Fragen Sie Ihren Tierarzt oder Apotheker, wie nicht mehr benötigte Arzneimittel zu entsorgen sind.
Einstufung von Tierarzneimitteln
Tierarzneimittel, das der Verschreibungspflicht unterliegt.
Zulassungsnummern und Packungsgrößen
Z. Nr. 840496
Packungsgrößen:
Faltschachtel mit 24 Injektoren und alkoholischen Desinfektionstüchern.
Plastikeimer mit 144 Injektoren und alkoholischen Desinfektionstüchern.
Es werden möglicherweise nicht alle Packungsgrößen in Verkehr gebracht.
Datum der letzten Überarbeitung der Packungsbeilage
10/2024
Detaillierte Angaben zu diesem Tierarzneimittel sind in der Produktdatenbank der Europäischen Union verfügbar (https://medicines.health.europa.eu/veterinary).
Rezept- und apothekenpflichtig.
